益生菌口服疗法可通过调节肠道菌群平衡以预防和治疗疾病,然而益生菌在到达结肠之前会显著丧失活力及生物活性,导致递送效率和治疗效果低下,因此限制其临床应用。近日,国际生物医学和纳米科学领域权威期刊《Advanced Healthcare Materials》(影响因子11.092)报道了我校“微纳生物技术”创新团队孟涛教授的研究成果“Multishell Colloidosome Platform with Sequential Gastrointestinal Resistance for On-Demand Probiotic Delivery”中文译名:“具有顺序胃肠道抵抗的多壳层胶体囊用于按需益生菌递送”(DOI:10.1002/adhm.202202954)。论文第一作者为beat365官方网站2020级硕士研究生谢鑫,通讯作者为孟涛教授,西南交通大学为唯一署名单位和通讯作者单位。文章报道了一种具有连续胃肠道抵抗力的多壳层胶体囊平台,用于按需益生菌递送,提供了一种有前途的增强口服益生菌功效的递送策略。该策略是迄今为止包封对胃酸和消化酶敏感的益生菌存活率以及结肠递送率最高的方法。
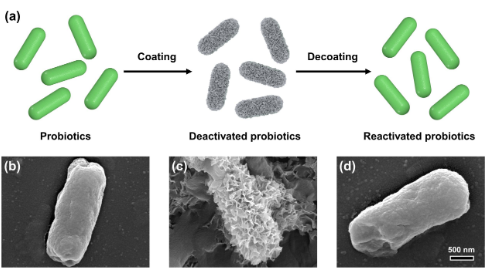
图1包封的益生菌展现出高的储存稳定性以及休眠、唤醒特性
文章亮点:①基于仿生矿化(图1)和微流控技术(图2)开发了一种具有连续胃肠道抵抗力的多壳层胶体囊(MSC)平台用于按需益生菌递送;②在保存过程中,MSC中益生菌的存活率相比游离细菌可增加280倍;③由于MSC具有连续胃肠道抵抗力,封装的益生菌持续暴露于极端酸度、胆汁盐侵蚀和酶促作用下,其存活率高达61%,而游离细菌为0%;④MSC主要在结肠中释放益生菌,促进益生菌结肠定植,维持肠道屏障完整性并调节肠道菌群的平衡;⑤MSC能显著改善对小鼠结肠炎的治疗效果。
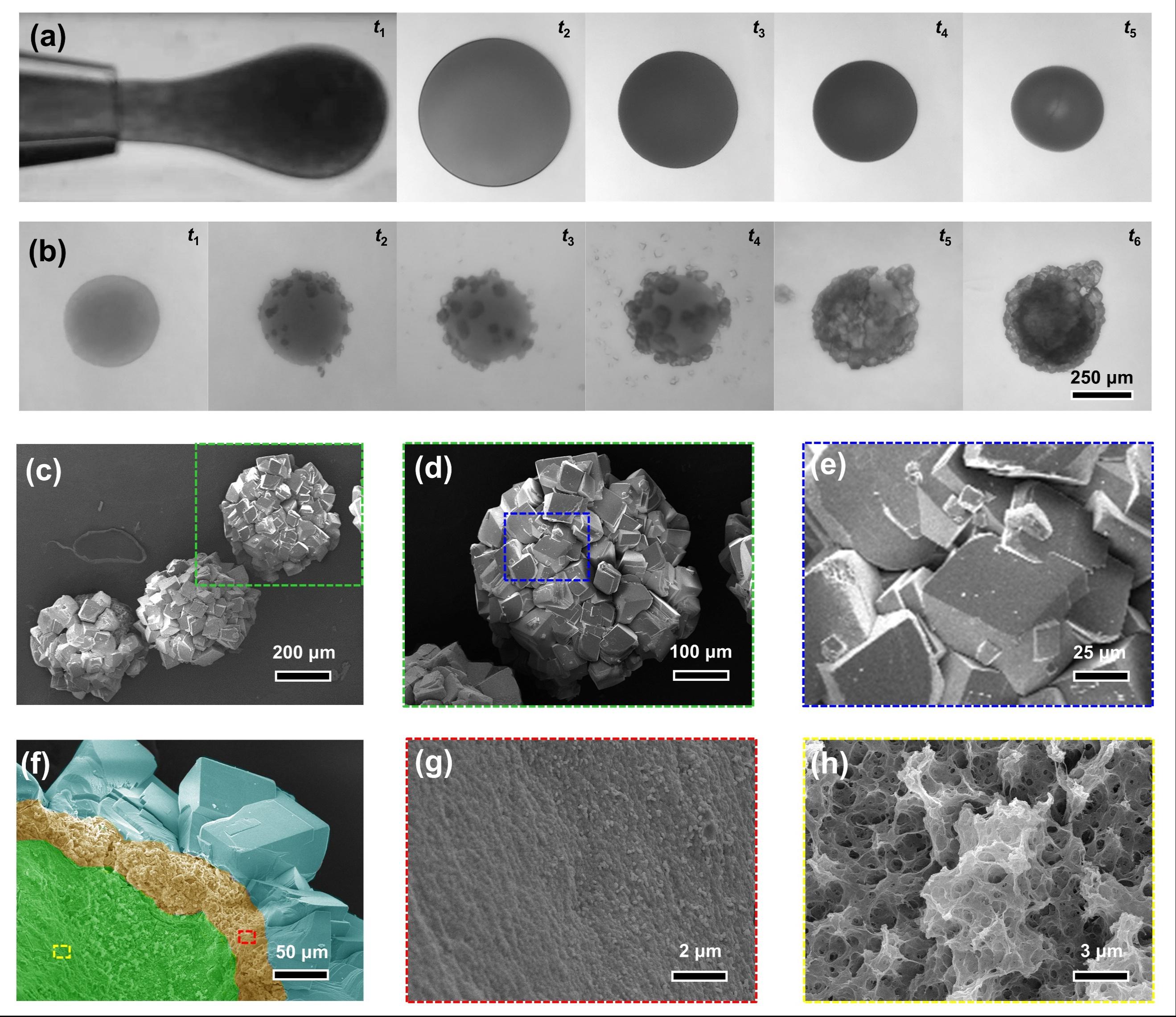
图2多壳层胶体囊(MSC)的制备和表征
总结展望:本研究开发的多壳层胶体囊递送平台具有顺序胃肠道抵抗和按需结肠释放特性,显著提高益生菌在各种环境压力中的存活率,并将其递送到结肠发挥积极的治疗效果,为细菌介导的疾病预防和治疗开辟新的途径。据悉,该研究成果正与生物技术企业开展成果转化。该研究得到国家自然科学基金项目(21776230, 22204130),四川省科技厅重点研发项目(2020YFG0092, 2022NSFS1211),中央高校基础研究基金(2682021ZTPY031, 2682021CX087)的资助。论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adhm.202202954
四川省劳模和技能人才创新工作室&我院“微纳生物技术”创新团队介绍:

以孟涛教授、邱忠平教授、廖海副教授、黄新河副教授、郭婷高工、王垚磊博士、李加洪博士、苑昊博士为主的科研团队聚焦微纳米尺度下生物反应和药物递送等重大问题,一直倡导将前沿性基础研究成果与国民经济发展和国家重大需求紧密相连。在以下方面开展科研工作:(1)微纳米尺度的生物反应分离、(2)微流控液滴技术的生命分析、(3)微纳米药物缓控释技术研究、(4)微纳米农业和环境生物技术。目前课题组正承担多项国家自然科学基金项目、省部级重点研发项目和企业合作课题。已发表高水平学术论文100余篇,申请国家发明专利50余项,并开展工业生物技术转化。
