近日,beat365官方网站周先礼教授团队在《Theranostics》上以我校为唯一署名单位发表了题为“Flubendazole elicits anti-cancer effects via targeting EVA1A-modulated autophagy and apoptosis in Triple-negative Breast Cancer”的研究论文,揭示了氟苯达唑通过靶向EVA1A调控自噬与凋亡机制抑制三阴性乳腺癌(Triple-negative breast cancer,TNBC)的生长和转移,从而发挥的抗肿瘤作用。《Theranostics》(IF=8.579)是中科院医学1区TOP期刊,2019年CiteScore值达到10.8,位列药理学、毒理学和药剂学(综合类)分区第1名,医学(综合类)分区第4名。

据了解,TNBC是世界范围内最常见的恶性肿瘤之一,也是导致女性癌症相关死亡的主要原因。目前TNBC的治疗手段中,因缺乏有效的靶向治疗,导致了如复发、转移等严重的不良预后反应。氟苯达唑作为苯并咪唑类广谱驱虫药物,近年来被重新定位为一种有效的抗癌药物与自噬诱导剂。然而,在TNBC的治疗手段中针对氟苯达唑诱导自噬的研究非常有限,其在肿瘤发生和转移中的作用鲜为人知。
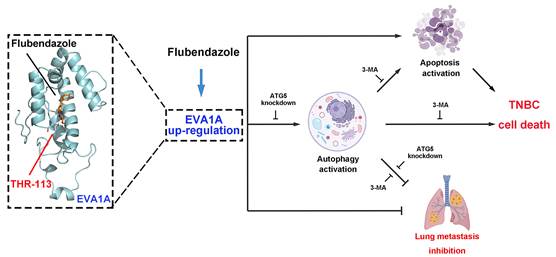
在本研究工作中,团队成员发现氟苯达唑能够诱导TNBC细胞发生自噬与凋亡,在体内外均表现出明显的抗增殖与抗转移活性。通过进一步研究发现,诱导自噬性细胞死亡是氟苯达唑抑制TNBC的关键,而阻断自噬将会降低氟苯达唑抗肿瘤效果。为了解析氟苯哒唑的潜在作用靶标,研究团队随后采用RNA测序技术(RNAseq)分析氟苯达唑处理的TNBC细胞基因表达谱的变化,同时结合免疫荧光、免疫组化、免疫蛋白印迹加以验证;通过基因敲除沉默EVA1A表达,发现氟苯达唑抗TNBC作用降低;当自噬相关基因ATG5受到抑制,氟苯达唑诱导自噬与抗增殖能力在EVA1A过表达的TNBC细胞中降低,揭示氟苯达唑通过靶向EVA1A调控自噬与凋亡而发挥抗TNBC作用。此外,研究人员采用同源建模确定了Thr113是参与氟苯达唑与EVA1A结合的潜在关键氨基酸残基。该项研究首次报道了氟苯达唑在TNBC中通过靶向EVA1A诱导自噬性细胞死亡,调控自噬与凋亡,发挥抗肿瘤作用。为探索氟苯达唑的抗癌作用提供新的见解,也为TNBC患者的个体化治疗提供了新的理论依据和治疗策略。
该研究在国家自然科学基金(81773605,81602953,81602627),中央高校基本科研业务费(2682020CX56)的资助下完成。beat365官方网站周先礼教授为论文最后通讯作者,符雷蕾副教授和张岚副教授为共同通讯作者,课题组博士研究生甄泳棋为该论文第一作者,硕士研究生赵荣演、王敏娟、姜星参与了部分研究工作。此外,相关研究工作也得到高峰教授的大力指导。
论文链接:https://www.thno.org/v10p8080.htm
